Tiêu điểm
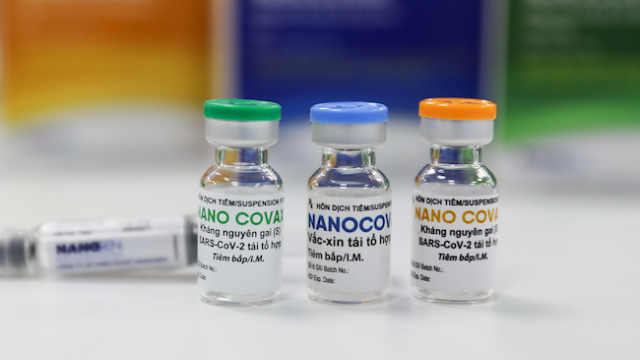
Chưa cấp phép khẩn cấp cho vaccine Nanocovax
Hội đồng Tư vấn cấp phép thuốc và nguyên liệu làm thuốc (Bộ Y tế) đề nghị nhóm nghiên cứu tiếp tục bổ sung một số dữ liệu vào hồ sơ vaccine Covid-19 Nanocovax.

Đến thời điểm hiện tại, Nanocovax của Công ty Nanogen là vaccine Covid-19 đầu tiên của Việt Nam triển khai thử nghiệm lâm sàng thứ 3; với 13.000 người tham gia, độ tuổi từ 18, bao gồm nhóm người cao tuổi, người có bệnh nền.
Pha 3 đã được thử nghiệm trên 13.000 người, chia làm 2 giai đoạn nhỏ (3a: 1.000 người và 3b: 12.000 người). Theo nhóm nghiên cứu, vaccine Nanocovax đạt yêu cầu về tính an toàn và tính sinh miễn dịch.
Tại buổi họp xem xét hồ sơ đề nghị cấp giấy đăng ký lưu hành vaccine Nanocovax do Công ty CP Công nghệ sinh học dược Nanogen đăng ký và sản xuất ngày 29/8 của Bộ Y tế với sự tham gia của lãnh đạo các vụ, cục liên quan và đại diện Hội đồng Đạo đức trong nghiên cứu y sinh học Quốc gia; Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đề nghị doanh nghiệp tiếp tục bổ sung một số dữ liệu vào hồ sơ vaccine Covid-19 Nanocovax.
Theo đó, Hội đồng Tư vấn đề nghị làm rõ các nội dung về tính an toàn: Bổ sung, cập nhật thêm dữ liệu an toàn cho toàn bộ đối tượng đã được tiêm ít nhất một liều vaccine tới thời điểm hiện tại và giải thích rõ về các trường hợp sự cố bất lợi nghiêm trọng (SAE) tới thời điểm hiện tại.
Về tính sinh miễn dịch, Hội đồng Tư vấn đề nghị bổ sung, cập nhật dữ liệu theo đề cương sửa đổi mới nhất được Hội đồng Đạo đức thông qua, bao gồm: Bổ sung, cập nhật đánh giá tính sinh miễn dịch trên các biến chủng mới (ví dụ biến chủng Delta, biến chủng Anh…) và cỡ mẫu đánh giá tính sinh miễn dịch cần thực hiện theo đúng đề cương nghiên cứu đã được thông qua.
Các nhà sản xuất vaccine Covid-19 thu lợi khổng lồ nhờ độc quyền
Về hiệu quả bảo vệ, đơn vị này đề nghị doanh nghiệp phối hợp với nhóm nghiên cứu để phân tích, bàn luận về mối liên quan giữa tính sinh miễn dịch của vaccine và hiệu quả bảo vệ tối thiểu 50% (theo hướng dẫn của Tổ chức Y tế Thế giới - WHO) dựa trên các dữ liệu y văn.
Sau khi doanh nghiệp khẩn trương bổ sung, cập nhật các nội dung nêu trên, báo cáo Hội đồng Đạo đức và Hội đồng Tư vấn tiếp tục xem xét, thẩm định cuốn chiếu các kết quả nghiên cứu để có thể cấp giấy đăng ký lưu hành có điều kiện trong trường hợp cấp bách.
Được biết, theo hướng dẫn mới nhất tại Thông tư 11/2021, "Quy định về dữ liệu lâm sàng trong hồ sơ đăng ký lưu hành vaccine", nêu rõ, vaccine phòng Covid-19 sản xuất trong nước đang thực hiện thử nghiệm lâm sàng nhưng đã có kết quả đánh giá giữa kỳ giai đoạn 3 về tính an toàn và hiệu quả bảo vệ của vắc xin dựa trên dữ liệu về tính sinh miễn dịch của vaccine, thì được sử dụng để xem xét cấp giấy đăng ký lưu hành có điều kiện.
Trước đó, ngày 7/8, Hội đồng đạo đức đã họp khẩn cấp để nghiệm thu kết quả thử nghiệm giai đoạn 1, đánh giá kết quả giữa kỳ thử nghiệm giai đoạn 2. Ngày 25/8, Hội đồng đạo đức tiếp tục thông qua báo cáo giữa kỳ giai đoạn 3a, sử dụng các kết quả nghiên cứu thử nghiệm lâm sàng tính đến thời điểm đánh giá kết quả giữa kỳ giai đoạn 3a, gửi cho Thường trực Hội đồng tư vấn để xem xét cấp phép khẩn cấp.
Xem xét cấp phép có điều kiện cho vaccine Nanocovax
Bộ Y tế đề nghị hỗ trợ thông quan nhanh nhất cho hơn 31 triệu liều vaccine Pfizer
Hơn 31 triệu liều vacccine pfizer từ Bỉ sắp về Việt Nam, do đó, Viện Vệ sinh dịch tễ Trung ương đề nghị các cơ quan hải quan hỗ trợ thủ tục thông quan để bảo quản vaccine an toàn trong quá trình vận chuyển.
Địa ốc Nam Phú Quốc tiếp tục nóng với triển vọng từ 'hộ chiếu vaccine'
Khu vực Nam đảo Phú Quốc với những dự án được quy hoạch bài bản trong hệ sinh thái đồng bộ tiếp tục trở thành điểm đến ưa thích cho khách du lịch cũng như nhà đầu tư địa ốc.
Các CEO thương hiệu hàng đầu kêu gọi Mỹ tăng tốc viện trợ vaccine cho Việt Nam
90 CEO của các thương hiệu hàng đầu Mỹ như Adidas, Coach, Gap, Hanebrands, Nike, VF, Under Amour, mới đây đã gửi bức thư chung kiến nghị Tổng thống Mỹ Joe Biden tăng tốc viện trợ vaccine cho Việt Nam.
Chi 9 tỷ đồng từ Quỹ Vaccine để hỗ trợ thử nghiệm vaccine Covivac
Thủ tướng quyết định sử dụng 8,8 tỷ đồng từ nguồn Quỹ Vaccine phòng Covid-19 để hỗ trợ thử nghiệm lâm sàng giai đoạn 1 và 2 vaccine Covivac.
Dữ liệu và công nghệ dẫn dắt cải cách hành chính tại Quảng Ninh
Quảng Ninh đang bước từ cải cách hành chính sang tối ưu hóa bằng dữ liệu và công nghệ, mở ra một cách vận hành dịch vụ công nhanh, minh bạch và thuận tiện hơn.
52 người chết và mất tích do lũ ở Nam Trung Bộ
Đợt lũ ở Nam Trung Bộ đang diễn ra, Đắk Lắk và Khánh Hòa là hai địa phương chịu thiệt hại nặng nề nhất về người, lần lượt ghi nhận 16 và 14 người chết.
Ngày 21/11 là ngày gì? Ý nghĩa và các sự kiện nổi bật ngày 21 tháng 11
Ngày 21/11 là ngày gì? Tìm hiểu ý nghĩa, các sự kiện lịch sử quan trọng của Việt Nam và thế giới diễn ra ngày 21 tháng 11 trong nhiều thời kỳ.
Liên hoan phim XXIV: Bước ngoặt kinh tế sáng tạo của điện ảnh Việt
Liên hoan phim Việt Nam lần thứ XXIV đánh dấu bước chuyển của điện ảnh Việt, từ sân chơi nghệ thuật sang một ngành kinh tế sáng tạo với tham vọng hội nhập toàn cầu.
Ngày 20/11 là ngày gì - Dấu ấn Việt Nam và thế giới trong dòng chảy lịch sử
Ngày 20/11 hàng năm từ lâu đã trở thành một mốc thời gian thân thuộc với người Việt Nam, gắn liền với truyền thống “tôn sư trọng đạo” và những ký ức học trò đầy cảm xúc. Nhưng nếu nhìn rộng hơn ra bối cảnh quốc tế, có thể thấy ngày 20/11 cũng là thời điểm diễn ra rất nhiều sự kiện mang tính bước ngoặt của lịch sử thế giới – từ những biến chuyển lớn của nền chính trị quốc tế, các phát minh khoa học – công nghệ, cho tới những quyết định quan trọng về quyền con người.
Dữ liệu và công nghệ dẫn dắt cải cách hành chính tại Quảng Ninh
Quảng Ninh đang bước từ cải cách hành chính sang tối ưu hóa bằng dữ liệu và công nghệ, mở ra một cách vận hành dịch vụ công nhanh, minh bạch và thuận tiện hơn.
Quỹ Touchstone Partners gieo mầm chuyển đổi xanh
Quỹ chuyển đổi xanh của Touchstone Partners sẽ bắt đầu giải ngân vốn từ tháng 12/2025, đồng thời cố vấn trực tiếp và hỗ trợ chiến lược cho các startup.
Ngân hàng chịu áp lực khi chạm trần tăng trưởng tín dụng
Tín dụng được dự báo duy trì cao, nhưng áp lực huy động và lãi suất tăng khiến việc cân đối vốn ngày càng khó khăn khi nhiều ngân hàng đã gần chạm hạn mức.
Kinh doanh thuận lợi, Eco Plastic muốn chuyển sàn chứng khoán
Công ty CP Nhựa sinh thái Việt Nam (Eco Plastic) có kế hoạch niêm yết trên sàn HoSE chỉ sau hơn một năm lên Upcom, trong bối cảnh kinh doanh thuận lợi.
KIS Việt Nam gia nhập làn sóng tăng vốn
Kế hoạch tăng vốn để bổ sung cho hoạt động cho vay ký quỹ và tự doanh chứng khoán, công ty kỳ vọng có thêm dư địa tăng trưởng hai mảng then chốt này.
F88 lấy con người làm trung tâm, văn hoá doanh nghiệp làm sức mạnh
F88 nhận cú đúp giải thưởng từ Anphabe, được vinh danh là "nơi làm việc tốt nhất Việt Nam" và doanh nghiệp sở hữu nguồn nhân lực hạnh phúc.
Nguồn cung văn phòng cho thuê ngoài trung tâm Hà Nội tăng mạnh
Xu hướng dịch chuyển trên thị trường văn phòng Hà Nội đang ngày càng rõ nét khi nguồn cung lớn được mở rộng ra ngoài khu vực trung tâm.